ap化学知识点梳理:ap化学原子间的关系
易鹿君
发布日期:2022-01-25 10:40:33

之前我们回顾了ap化学知识点梳理中原子的组成结构、Electron configurations的写法和元素周期表等等原子层面的知识点。这次分享将会在上次分享的基础上带着大家复习原子间的关系,在这篇推文里指原子间的作用力和它们之间的形成的bonds。
01 Types of Molecular Bonds(化学键分类)
要让多个原子或者离子聚在一起为一个分子,它们需要chemical bonds(化学键)在其中作为链接。当然,说是bonds,实际上当然没有实际的东西将它们联系起来,它们是由原子间的相互作用力联系在一起的。 上次分享也提到过,如果每一个原子的质子数、电子层和最外层电子数不同,它们能从其他地方吸引来更多电子的能力也不同。
小回顾:在元素周期表上,基本上是左下角的元素electronegativity 最低,右上角元素的electronegativity最高的规律。
一个分子间不同元素的electronegativity差距越大,电子在两个原子间的分布情况越不均匀。下面我将带大家回忆molecular bonds的几个种类,再回顾一下如何判断一个分子的bond type。为了简便,以下知识点回顾里面我们只考虑两个原子之间的化学键。 2020-2021的AP考纲里有提到以下三种Molecular Bonds: Ionic Bond:electron are transferred
因为electronegativity差距太大,电子直接从一个原子转移到了另一个。 Covalent Bond:electrons are shared
Electronegativity差距相对较小,两个原子share一部分电子。 Covalent bond可以细分为两种:
→polar covalent电子分布不均匀,更偏向electronegativity更强的那一边。
→nonpolar covalent电子分布相对均匀,两个原子的electronegativity 差距不大,因此吸引电子的能力也差不多。 Metallic Bond:electrons are freely transferred from one to another
这种不太常考,是metallic solids中常见的化学键。这是因为对于金属元素,围绕着它们的电子相对会更加delocalized。一般会在纯金属或者合金看到这个bond。 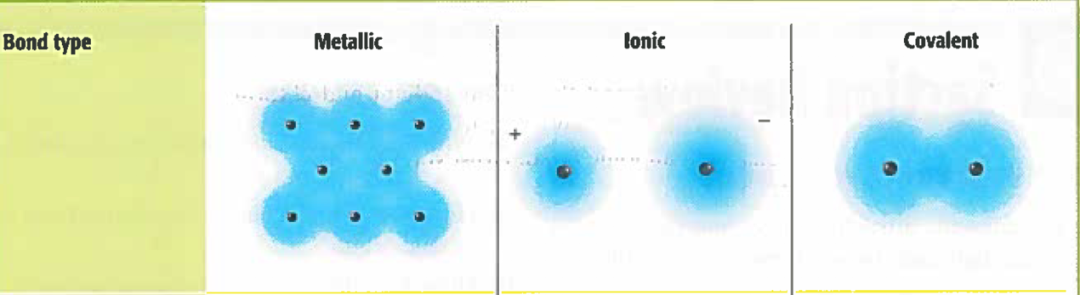
图1. Molecular Bond Types
那么如何判断两个原子被放在一起会形成什么bond呢?
1. 最简单直观的方法是看它们之间electronegativity的差距。通常Ionic bond的electronegativity 大于2.1,polar covalent bond在0.5和2.1之间,nonpolar covalent bond则是小于0.5。
2. 当你稍微熟悉每个元素在元素周期表上的位置,就可以更快根据元素的性质判断。在大部分时候:metal + nonmetal的组合 →Ionic
都是nonmetal的组合→Covalent
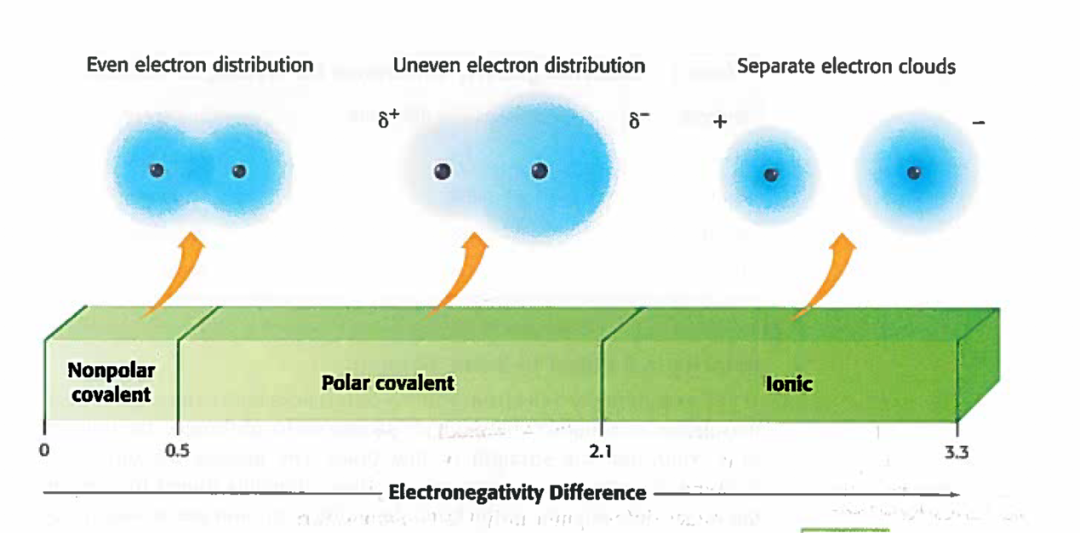
图2. The relationship between electronegativity differences and chemical bond types
02 Intramolecular Force & Potential Energy
上次还提到,质子为正级,电子为负极,两者因此会互相吸引。我们把这样一种互动关系称为interaction。 有些bond会比另外一些更加强,而能让几个原子之间更加紧密的原因除了electronegativity, 还有这些可以增强intramolecular interactions:
Charge: The larger the charge, the stronger the interaction.
电子数如果越多,正负相吸也会更强烈。
Ion size : The smaller the ion, the stronger the interaction.
离子越小也就是指的它的半径更短,两个原子之间的距离更近,自然就会让两个原子之间的interaction更强。
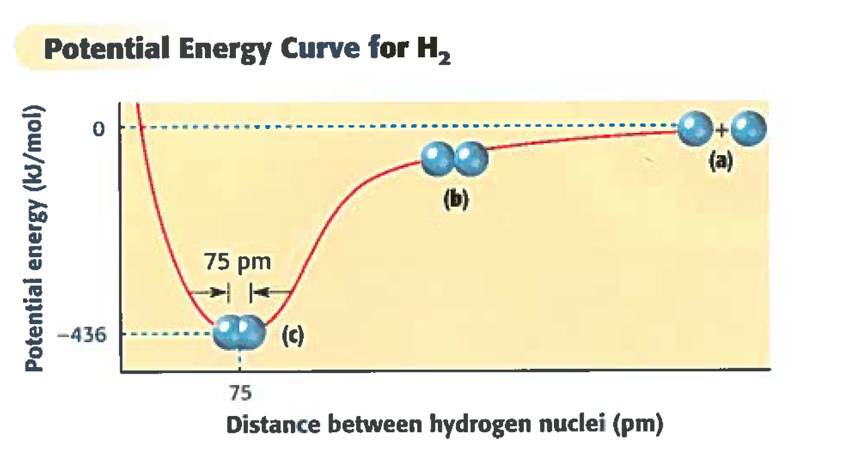
图3. 分子内原子间的potential energy 与两原子之间距离的关系
除了原子和离子本身的大小之外,bond的长短也可能造成potential energy的不同:single bond比double bond更长,triple bond最短。Break triple bond所需要的能量是最高的,这一点在后面讲到free energy, enthalpy, entropy等内容的时候也会提到。
03 Lewis Diagram
这个知识点必考,相当重要!它能帮助我们推出每个原子(或离子)最外层电子的分布情况, 可以形成什么化学键(包括种类和single bond/double bond),还可以让我们知道这个分子的geometry。 画Lewis Diagram (也叫Lewis Structure)的时候有几点需要注意:
1. 算出valence electrons的总数,原子form bonds以后electrons的总数仍然应该不变。
2. 遵循octet rule,即每个原子都想要自己的最外电子层有八个电子(在AP考察范围内的是这样,即Period 4及以前)。Hydrogen为例外,只需要两个。
3. 选出C位,确认central atom。通常electronegativity最小的原子在中间,而Hydrogen 或者其他的Halogens(分别对应元素周期表Period 1和Period 17)都会在边上。 【AP例题】
来做个练习题试试手吧~ 大家可以先自己练一下,然后再下滑看底下的正确答案。
这一题选自2018 AP Free Response 2d 的第一问。 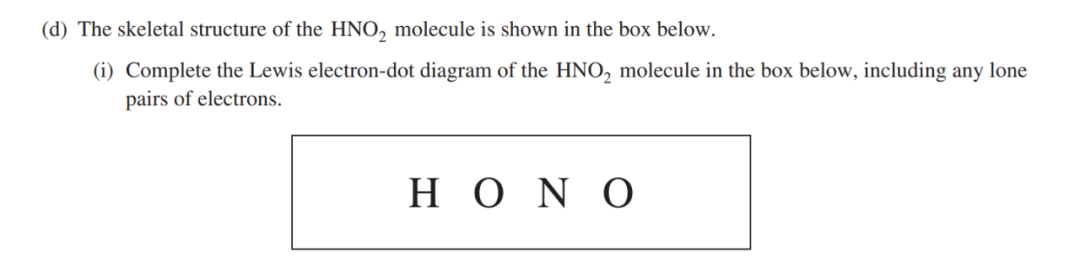
【答案解析】
我的解题思路如下:1. 题目已经帮我们选出了central atom,省了一步力气。2. 算出total number of valence electrons。H:1, O:6, N:7#Total number of valence electrons: 1+ 6*2 + 7 = 20
3. 确保每一个原子的电子都满足octet rule(H作为例外是两个电子)。我在图中用不同颜色圈出了每个原子符合octet rule的原因,主要不要忘记shared electrons。如果你画了bonds,在检查电子个数的时候记得一个bond代表一个electron pairs, 也就是两个electrons。
【官方答案】
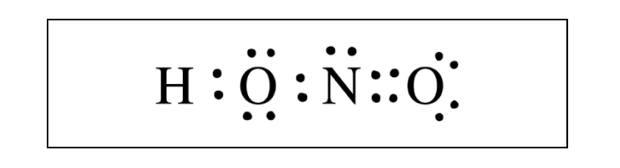
注意:原子间share的electron pairs也可以用横线来代替,都是chemical bonds。如果你用的横线,NO之间的应为double bond。
04 VESPR(Valence Shell Electron Pair Repulsion Theory)
在复习原子结构的时候我们反复说过它们的最外一层都是电子,都是负极,而同极相斥,因此每一个原子之间都得保持一定的距离。当多个原子被放到一起,每一个原子都尽量给彼此更多空间(就像社恐的我和我的社恐室友)。
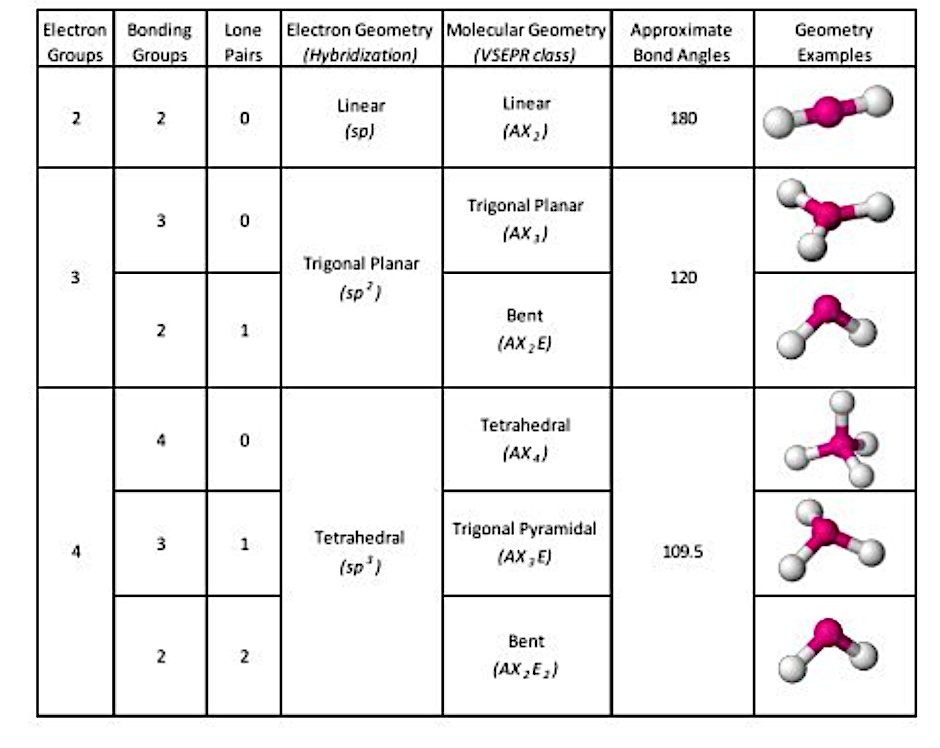
图4. VESPR(图片来自互联网)
【AP例题】
刚刚做的2018 AP FR 2d还有第二小问。

【答案解析】
根据图4,其实简单确认一下central atom,再看一下它有多少个electron groups 就可以。这里从右往左第二个氮原子上有三个electron pairs,我们直接选择sp2。下面这个图可能更加直观一点,我个人也更喜欢用横线来表达bonds,原因之一就是判断geometry的时候更方便。
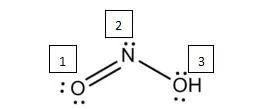
【官方答案】sp2 正如我们刚刚看到的2018年真题,Lewis Structure 和VESPR两个知识点因为思路比较顺,很容易一起考察。 还有一种考察方法是直接让你画Lewis structure,这个时候注意,除非题目明确指出你不需要indicate geometry,否则保险起见还是建议在好好画好electrons和bonds的基础上想想VESPR和geometry,用3D而不是2D的思路去画。 AP还会出一些选择题来考察这个知识点,除了直截了当地问你geometry,还可能问bond angles或者hybridization。
【例题】
官方不会放选择题真题,所以我为大家编写了两个小问题,大家可以感受一下~(但比较基础)。答案和解析依旧在最后~
1. What is the bond angle of CH4?A)180B)120C)109.5D)90 2. What is the geometry of CH4?A) linearB) tetrahedralC) trigonal pyramidD) octahedral
【答案和解析】1. C
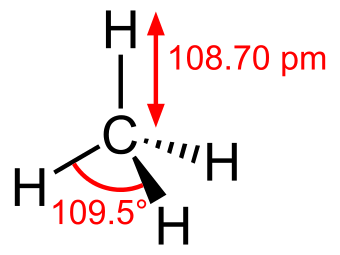
结合这张图和图4就很明了啦,H的特殊情况必须在最外,所以C是唯一可能的central atom。四个bond连着,所以four electron groups,对应图4里的109.5度。 如果你想的是360度除以四等于90度,那么你想对了第一点:每一个原子互相离的越远越好。但注意,360是平面的而不是3D的。 2. B也可以看图4里,4个bonding groups, 0 lone pairs, 对应了tetrahedral。(另外,第二题的D选项octahedral AP不会考的,是被我拉进来凑数的。)
又到了我的亿点点tips环节!
Intramolecular 和 intermolecular 这两个词不要混淆,前者指分子内,后者指分子间。(这个intra-和 inter- 的区别如果记住了,不仅是在化学,在很多其他科目也有用哦,比如AP美国政府会提到的intrastate州内和interstate州际。)
举例说明,如果你面前有一瓶水,那么里面一个水分子(H2O)里氢原子和氧原子之间为intramolecular,根据它们的electronegativity difference, 该是polar covalent bond。每一个水分子(也就是说每个H2O为一个单独整体)之间的关系是intermolecular。 P.S. 如果你想到hydrogen bond,那就是混淆了!Hydrogen bond属于intermolecular bond,下一篇才会讲哦,大家可以期待一下~
总 结
本篇干货分享主要讲的molecular bonds,也可以说是intramolecular interactions。这些内容比较基础,尤其是电子的分布和分子的geometry,对于之后推测一个分子的性质可以起到关键性的作用。 最近的分享从原子结构讲到原子间的interactions,你或许可以猜到下一篇将会是intermolecular interactions,也就是分子间的关系。
我们下期再见啦!更多AP化学真题及资料,扫码联系小助手,免费领取!

©特别声明,本站遵循行业规范,任何转载的稿件都会明确标注作者和来源,如果来源或作者有误,请及时联系我们更正.

ap化学知识点梳理:从atomos的角度看世界
当我们开始学习化学, 我们就开始从微观的角度来观察和研究这个世界。今天ap化学知识点梳理里我们就从微观角度,或者原子层次上开始思考物质的组成。 ……[查看]
2023-02-28

ap考试五分容易吗?备考AP这个环节最重要
ap考试五分容易吗?在过去,我们针对参加过AP考试的学生做过这样的问卷调查:“作为学生,你觉得在备考AP的过程中哪一部分最重要?”出人意料的是,被选择最多的竟然不是上课 ……[查看]
2023-02-21

热门AP理科学科有哪些?
申请竞争日益激烈,标化成绩也是水涨船高,AP成绩作为“优中择优”的标准之一,愈发被名校看重,AP课程除了可以增加名校申请概率、换学分提前毕业这些快被说烂了的原因,还 ……[查看]
2023-02-09

ap心理学是什么,学心理还要学生物?
ap心理学是什么?大家小时候有瞎拆东西的经历吗? 无论是什么东西——比如遥控器、机器人、雨伞、收音机——只要到了我的手里,就一定会被拆得四分五裂,因为我很好奇这 ……[查看]
2023-02-03
最新动态













