ap化学目录之thermodynamics考点分析
易鹿君
发布日期:2022-02-02 09:10:41

今天的分享继续复习ap化学目录之thermodynamics考点分析,并且这次的内容被考到的概率也比较高哦(因为出题人知道如果你搞明白了这些知识点,说明前面内容的知识点你也基本都有掌握)。
除了会在选择题考察概念,thermodynamics在free response中也会经常出现,附带很多的公式和计算,需要大家特别细心哦(特别是注意好正负)!
01 Entropy ΔS °
在生物和化学课上,lecturer们都会用“randomness”, “disorder”这样的词语来形容entropy。想象一个密闭的空间里面有一堆分子,它们的排列规律或是活动规律越random,这个system的entropy值也就越高。 和enthalpy一样,比起一个固定的值,我们通常说的是一个变化,某一个system现在的entropy和它自己之前比是增多还是减少:增多则 ΔS° >0, 减少则 ΔS° <0。AP出题时会给我们一些变量,考察它们发生变化后对这个system 的entropy会产生什么影响。 让我们还是以一个封闭的空间作为帮助我们想象的道具,想象以下几个变量变化后分子们的“randomness”会怎么改变:Temperature
Phase(Gas/ Liquid/ Solid)
Concentration of Aqueous solution
这些道具其实能给大家一些思路上的提示:从分子的层面上考虑这些变量如何改变entropy。
我的思路是这样:
Temperature
温度越高,分子运动的越快,那么这个system里的disorder就会升高。All other factors being equal, entropy increases as temperature increases.
Phase(Gas/ Liquid/ Solid)
不同的状态变化特别的地方在于,他们的intermolecular space(分子间间隔)不同。例如同样都是1mol那么多的水分子,它作为冰(solid)就比作为水蒸气(gas)时要稳定的多,因为在分子数量相等的情况下,冰占用的体积更小。这意味着每一个在固体状态下的水分子活动的空间会更小。All other factors being equal, the extent of entropy is ranked as gas> liquid> solid.
Concentration of Aqueous solution
Concentration增加到原来那个密闭空间里,意味着更多的分子需要共享原来的空间。因此,每一个单独的分子活动空间更小。All other factors being equal, entropy decreases if the concentration of aqueous solution increases.
当我们需要计算一个化学反应的entropy change, 可以产生所有product需要的entropy,减去产生所有reactants 需要的entropy。 可以用以下这个公式进行概括(注意stoichiometry):ΔS°reaction = ΣS°products – ΣS°reactants
例如 2 H2 + O2 → 2 H2O 这里 ,← ΔS°reactants 就是(2 *ΔS°H2 + ΔS°O2),ΔS°products 为2 * ΔS°H2O。
02 Gibbs Free energy ΔG°
在standard state(pure substances, as solutions of 1.0 M concentration, or as gases at a pressure of 1.0 atm)的情况下,一个化学反应从reactants 到products 所需要的能量变化被称之为Gibbs Free Energy ΔG°。 我们可以用ΔG°来判断一个equilibrium reaction是否spontaneous。如果ΔG°<0,则反应为spontaneous, 反之则为non-spontaneous。
Mini review:spontaneous 的意思是这个化学反应会自发发生,又称之为thermodynamically favored。反之,如果两个reactants互相的反应为non-spontaneous,那么即使把它们放在一个地方,他们也不会自发产生什么化学反应。
类似于entropy,我们也可以分别计算products 和reactants 的free energy值,然后求他们的差来获得一个反应的ΔG°,公式为:ΔGreaction° = Σ∆Gf °products − Σ∆Gf °reactants
有时候我们需要通过enthalpy, entropy 和temperature来得出一个反应的ΔG°。可使用这个公式:ΔG° = ΔH°− T ΔS°
看到这个公式的时候是否有意识到为什么我在开篇说,学好thermodynamics,弄清楚正负至关重要?
因为这个公式里的enthalpy 和entropy 的正、负可以直接决定最终G的正负,从而影响这整个reaction是否会发生。而T有时候又是一个至关重要的变数,它的大小可以决定entropy的正负在整个计算里起到多大作用。 如果你有一点被绕晕了,别担心,实际上做题起来会很容易! 而如果你赶时间,偷偷告诉你其实AP官方已经帮你打好了小抄…
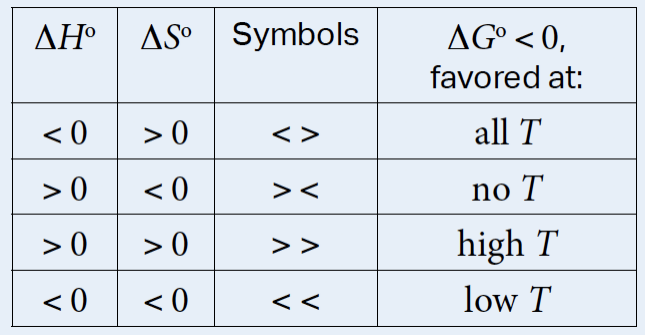
注意这个at all/no T: 这里的意思是说,当ΔH°<0, ΔS°>0,不论温度如何,ΔG°都会是<0。
反之,ΔH°>0, ΔS°<0的话,不论温度如何,ΔG°都会是>0。 还有一个常用的公式:ΔG= -RT ln K
这里的R是一个常数,就像刚刚mini review里提到过的, 我们可以用ΔG来predict这个reaction 是否为thermodynamically favored。在这个公式中,K代表的是equilibrium constant。如果K>1,那么products就是favored at equilibrium。这个在equilibrium 知识点分享中有更细节的介绍,这里就不再赘述啦。 重新整理这个公式我们还可以得到:
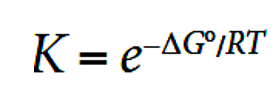
简单来说,如果ΔG°<0, K > 1, products are favored。
反之,如果ΔG°>0, K< 1, products are favored。 最后,有standard state(有些朋友是不是都忘了standard state在开头出现过了?),就有non-standard state。不过要注意Le Châtelier’s principle针对的是equilibrium的情况,在此处并不适用。那我们怎么计算non-standard state下的electrical energy呢? 这里我们可以用到Nernst Equation:ΔG= ΔGo - (RT/nF) ln Q
这里的n代表在反应中被transfer的电子数,F为常数96485 C/mol,Q则为[product]/[reactants]。我知道这样乍一看有一点乱,所以可以看一下下面的例子: 我们可以把K理解为Q比较特别时的一个值,在equilibrium, Q=K时ΔG=0直接把公式左边设为0。
03 Coupled Reactions
对于这个概念,AP给的官方解释是:
An external source of energy can be used to make a thermodynamically unfavorable process occur.
也就是说,有一些化学反应ΔG°>0,并不是反应很强,所以需要额外借助外部的能量来促进这个反应的发生。 这个概念对我而言一开始对我有点陌生,但后来我一品,不就是“蹭热度”吗?? 举例:有些生物基础的朋友们会知道ATP在我们的细胞中必不可少,保持正常的能量供应。而ATP的hydrolysis(水解)的ΔG°<0(-30.5 kJ/mol),也就是说,这是一个可以产生很多能量的反应。
细胞们非常机智地把ATP hydrolysis 与另一个ΔG°>0的反应进行绑定炒作,用某一种酶把它与glucose 到 gluocose -6 – Pi 的反应(这个反应ΔG°=14.3 kJ/mol , >0)结合起来。这两个的总ΔG°<0,因此原本thermodynamically unfavor的反应也可以发生。这种需要借助外界帮助的,原本ΔG°>0的,我们成为coupled reactions。
一些Tips需要大家keep in mind:
1. 不要忘了Δ和°的存在!虽然小,但它代表着standard state的意思,是不可或缺的。
2. Spontaneous reaction有时候因为spontaneous一词多义,也可以表示为“顺时的,”为了避免误会,我们多用”thermodynamically favored”来形容今天提到的会自发发生反应的化学变化。
3.Thermodynamics 不等于 Kinetics!ΔG为负数只能说这个reaction是 thermodynamically favored, 不能告诉我们关于这个反应发生的快慢的任何信息。
4. 注意ΔS°reaction = Σ∆S°products – Σ∆S°reactants ΔG°reaction = Σ∆Gf °products − Σ∆Gf °reactants
这两个公式都要注意stoichiometry。但,上次分享里的Hess’s Law则不用,注意区分。
5. ΔG= -nF*E这里的E建议为了和F的单位匹配,用J/mol而不是kJ/mol。 04AP例题解析
AP考试中的FRQ一般会将这几个知识点结合在一起考察。我们来看官方公布的2019年AP Chemistry FR第一题~ 这边我选了与今天分享的内容相关的几个小题(Urea的化学式为H2NCONH2):

【官方答案】

首先,从微观的角度思考,Urea在aqueous状态下分子间的间隔更大,每个分子的活动空间更大,这个system就有了更多“disorder”。因此,我们得出的aqueous urea的S值肯定要比它是固体时要高。
然后这题就其实是一道数学题了:从表格中我们可以得知Urea在固体状态下entropy的值为104.6 J/mol·K,又知道从固体到aqueous状态需要70.1 J/mol·K,那么aqueous状态下的entropy 值就为两者的和。

看来在解释(f)小问aqueous值为什么是change和solid的和的时候我已经预判了这个小问!不过官方的说法我们还是要学习一下的哈: “increased number of possible arrangements” 
官方答案已经解释得很详细啦,但我知道很多同学对于这种解释概念的题目有一个相同的困扰:道理我都懂,但是说不出啊。 我的建议是,先直接把公式摆出来,说:“According to this equation, …” 那么已经改卷到头昏脑胀的判卷老师就首先能非常直观地了解到你知道这个题目考查的是哪一个知识点。然后你只需要补充解释一下,当题目问到的这个变量改变的时候,根据这个公式会发生什么后果就可以了~
本期干货内容的分享强调了很多次分清正负。一旦懂得了概念,其实分辨出它们是否是正数或者负数并不难,难的地方在于记住每一个项的sign,且逻辑一直清晰在线,如果两道题紧挨着的话还不能弄混。 所以这里给大家的一个小建议是与其在脑袋里记住,不如记在纸上(这一题的ΔH是>0, 那一题ΔS<0) 来帮助自己记忆。甚至记住公式的话也可以当场根据公式推,其实比背AP画的小抄表格还要方便哦,毕竟这样你还顺便检查了一轮这样做对不对。 好啦,这次的分享就到这里,希望对你有帮助,我们下期再见哦~扫码免费领国际课程资料!

©特别声明,本站遵循行业规范,任何转载的稿件都会明确标注作者和来源,如果来源或作者有误,请及时联系我们更正.

ap化学知识点梳理:从atomos的角度看世界
当我们开始学习化学, 我们就开始从微观的角度来观察和研究这个世界。今天ap化学知识点梳理里我们就从微观角度,或者原子层次上开始思考物质的组成。 ……[查看]
2023-02-28

ap考试五分容易吗?备考AP这个环节最重要
ap考试五分容易吗?在过去,我们针对参加过AP考试的学生做过这样的问卷调查:“作为学生,你觉得在备考AP的过程中哪一部分最重要?”出人意料的是,被选择最多的竟然不是上课 ……[查看]
2023-02-21

热门AP理科学科有哪些?
申请竞争日益激烈,标化成绩也是水涨船高,AP成绩作为“优中择优”的标准之一,愈发被名校看重,AP课程除了可以增加名校申请概率、换学分提前毕业这些快被说烂了的原因,还 ……[查看]
2023-02-09

ap心理学是什么,学心理还要学生物?
ap心理学是什么?大家小时候有瞎拆东西的经历吗? 无论是什么东西——比如遥控器、机器人、雨伞、收音机——只要到了我的手里,就一定会被拆得四分五裂,因为我很好奇这 ……[查看]
2023-02-03
最新动态













