AP化学知识点梳理:Thermodynamics热力学
易鹿君
发布日期:2022-02-02 09:59:58

今天本文将以College Board官方给出的最新一学年的guideline为基础来帮助同学们梳理AP化学的知识点。
本文内容将对应Topic 6:Thermodynamics (热力学),AP主要考察的这方面的内容包括能量守恒,能量的转换,做功等。
这些概念对于有物理基础的同学们来说会相对熟悉,上手或者复习起来会更佳容易,不过AP化学的范畴里我们除了了解这些基本概念之外,更多的还是从微观的角度思考forming / breaking chemical bonds 而产生的能量。
本文目录
Part 1:重要概念回顾
(1) 1st Law of Thermodynamics
a) System and Surroudings
(2) Exothermic, endothermic
(3) Heat Transfer
(4) Enthalpy
a) Bond Energy
(5) Hess’s Law
Part 2: AP考查题目
01重要概念回顾
重要概念(1): 1st Law of Thermodynamics Energy can be converted from one form to another, but it is neither created nor destroyed.
我们在生活中见过不少例子符合这个定律, 能量可以由一种转移至另一种,而不是凭空产生也不是凭空消失: 植物吸收太阳光里的light energy,在其体内自我转化成为chemical energy;
冬天我们感受到冷的时候,通过快速摩擦手心这样的动作让kinetic energy转化为thermal energy;
使用插上电的微波炉加热食物,则是chemical energy到thermal energy 的转换…
不过这句定义里的energy指的是整个宇宙中的energy,因为这一切都被同一个宇宙包含在内,其中的能量变化守恒——但对于我们来说,我们通常关心的能量之变化是对于一个小的多的物体。 如果我们关注的对象是一块冰,那么我们会称其为System,我们关心这块冰的internal energy,而它周身的所有的东西都是Surrounding,可以是放这块冰的杯子,也可以是空气(注意空气也和这块冰直接接触)。 
重要概念(2): Endothermic & Exothermic
复习了system和surrounding 的概念后,我们就可以开始考虑如何形容一个energy flow,也就是如何表达一个能量从一体转到另一体。 还是拿那块冰举例,当它开始融化,你可以想象它从surrounding吸取heat, 这是一个endothermic reaction (吸热反应)。常见的endothermic reaction除了融化,还有hydrolysis, evaporation, photosynthesis等等。 而对于它周身的环境,比如那个杯子而言,这个过程则需要它释放热量,因此对于杯子而言这是一个exothermic reaction(放热反应)。常见的放热反应还有combustion,强酸和强碱的反应等等。 当被问到某一个反应是endo 还是exo的时候,不妨如上文一样想一下这个能量是从哪里到哪里。热量的转移是可以通过温度观察到并推测出的,也就是:当一个物体温度降低↓,证明它的热量正被转移到另一个物体上,所以做类似题目的时候也可以考虑通过日常生活可以观察到的现象来回忆这些概念。 【易错点】做题时要看清题干里为你选择的system是什么!
之前有学生遇到过这样一道题:A cup of water is being heated. Please indicate whether this process is endothermic or exothermic…
很多同学想着水被加热是吸收热量就毫不犹豫写了endothermic,做错后才发现题目其实问的是这个过程对于加热水杯的蜡烛是endothermic还是exothermic。 注意,Endothermic 对应的Internal Energy符号是“+”, Exothermic的符号则对应“-”。 重要概念(3): Heat Transfer
不管是放热反应还是吸热反应,我们都可以用下面这个公式来量化它。 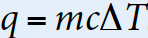
q= the heat absorbed/ released (J/mol), 也可以说是被转移的热量。m= mass of the substance (g), 这个物体的质量,注意单位是克。c= heat capacity (J/g*K),比热容是一个常数,根据考虑的物体是什么会有所不同。ΔT = temperature (K) 注意这里是温度的变化,以及单位是Kelvin。有时候AP会故意给你摄氏度来考察你是否注意到要考虑单位,这时候记得要先换算好:0 K + 273.15 = 1 Celsius 
重要概念(4): Enthalpy (焓/ΔH)
The enthalpy change of a reaction gives the amount of heat energy released (for negative values) or absorbed (for positive values) by a chemical reaction at constant pressure
Enthalpy基本上也就是一个代替表示endothermic/exothermic reaction中system放出或者收到energy的值。 ΔH > 0, system吸收了热量→Endothermic Reaction
ΔH < 0, system放出了热量→Exothermic Reaction
可能会有同学提出,这似乎和前面的internal energy 一样啊?
Internal Energy和Enthalpy其实并不是一回事,但它们的区别在AP的考查范围之外,目前我们可以把它们放在一起记忆。另外,AP强调了这是在constant pressure的情况下,实际情况中pressure也是有影响的,只不过AP不做要求。 Bond Energy
在AP化学的考察中,Bond energy也可以约等同于bond enthalpy。
ΔH°reaction = Σ∆Hf ° bonds formed in reactants − ΣΔHf °bonds broken in products
在一个化学反应里,首先bonds of reactants break,这意味着对应的那些分子需要吸收一定的能量。然后bonds of products form,也就是说有一些分子的能量会需要放出能量。
计算这个的时候需要考虑到number of moles, 例如: 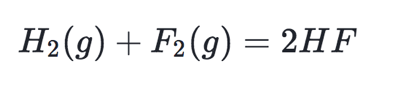
套用公式:Step 1:我们应该算出form 2 mol HF需要的enthalpy(Σ∆Hf °products)Σ∆Hf °products = 2 mol * 568 kJ/ mol = 1136 kJ
Step 2:分别再把break 1 mol of H2和F2 分别需要的enthalpy 加起来(ΣΔHf °reactants)Σ∆Hf °reactants = 436 kJ/ mol +158 kJ/ mol = 594 kJ
Step 3:用第一步求出的Σ∆Hf °products 减去ΣΔHf °reactantsΔH°reaction = 594 kJ – 1136 kJ = -542 kJ (另外, AP会在index或者题目里提供每种bond对应的energy,不需要另外记忆!) 最终得到的ΔH°reaction 决定整个reaction是endothermic (+)还是exothermic (-)。 重要概念(5): Hess’s Law
通过Hess’s Law, 我们知道以下两点:1. 当反应的Equilibrium shift left, 那么这个反应所对应的ΔH则与原来有相同数值,但符号则相反。也就是说:
A + B→C + D,←
Equilibrium 如果原本会shift right,则右为products 左为reactants。当我们反过来,A、B成了products,C和D成了reactants,我们只用把原来的ΔH前的符号改变就够了。 2. 当你想知道多个reactions造成的ΔH变化,只需分别把products和reactants的ΔH算出,加在一起就可以。 比如,如果我们想知道以下这两个reaction加起来后enthalpy的变化
A + B→C + D, C + E→F+G ← ←
首先要注意到,C同时出现在两个式子的不同边,这意味着它们会被cancel out(在numbers of mols相等的情况下),因此我们最终看到的式子应该是:
A + B+ E → D+F +G,←
提前做这一步整理可以让你在计算部分少费点精力。
接着,我们仍然依照之前的三步:Step 1:算出D,F,G三者ΔH的和Step 2:算出A,B,E三者ΔH的和Step 3:用Step 2中得出的数值减去Step 1中得出的数值 这从微观角度很好解释:我们只是根据不同的情况需求,把break bonds的情况和form bonds的情况通过这个公式整合在了一起。 02
AP考察题目
1. Energy Transfer
在前文中我已举过几个能量转移的例子,AP考试可能会出一道选择题,选项分别都是这样的例子,让你去判断对错。通常如果该选项错误,错误的地方就在于energy的种类,同学们可以重点关注下。 另外,AP也会用phase change来考察你对endothermic/exothermic 的理解。 我们仍然以H2O为例:Melting EvaporationH2O (s) → H2O (l) → H2O (g)← ←Freeze Condensation 上面的一排(melting, evaporation)都是endothermic,下面的一排(freeze, condensation)则都是exothermic。题目里可能一上来就问你evaporation是吸热还是放热,而用这个表则可以帮助你结合生活经验记忆。 当然我们也可以从微观的角度想:从左到右分子间的距离(intermolecular distance)是渐渐变大的,而正是吸收了更多的能量才让这些水分子更加活跃,扩大intermolecular distance。 考试Tips——易错点
有一个非常重要的易混淆项: 偶尔会遇到这样的选择题选项,说一杯热水比起一杯冰水“contains more heat”,让你判断这句话的对错。先给大家点时间思考下…
大家别忘了Heat是一个process!它代表着能量从一个物体转移到另一个物体的那一个过程,你也可以直接记heat transfer, heat exchange, transfer of energy as heat等等。 因此,这个选项是错误的❌, 我们不能说一个物体contains heat,我们可以用thermal energy来代替,它们的单位都是kJ/mol。 同时还有Temperature这个概念也可能与这两个混淆,它代表的是温度。如果概念仍然太抽象不好理解,不妨考虑它们的单位。Heat和thermal energy的单位是kJ/mol,而Temperature则是摄氏度或者华氏度。
考虑单位还有的好处就是在free response的计算部分,把单位和数字都写上,如果最后得出的单位不对也能帮助你检查式子是否列对。 Summary
这一章其实不难,同学们可以多结合生活经验来理解概念,并且在计算的时候要耐心且仔细(带好单位!)

©特别声明,本站遵循行业规范,任何转载的稿件都会明确标注作者和来源,如果来源或作者有误,请及时联系我们更正.

ap化学知识点梳理:从atomos的角度看世界
当我们开始学习化学, 我们就开始从微观的角度来观察和研究这个世界。今天ap化学知识点梳理里我们就从微观角度,或者原子层次上开始思考物质的组成。 ……[查看]
2023-02-28

ap考试五分容易吗?备考AP这个环节最重要
ap考试五分容易吗?在过去,我们针对参加过AP考试的学生做过这样的问卷调查:“作为学生,你觉得在备考AP的过程中哪一部分最重要?”出人意料的是,被选择最多的竟然不是上课 ……[查看]
2023-02-21

热门AP理科学科有哪些?
申请竞争日益激烈,标化成绩也是水涨船高,AP成绩作为“优中择优”的标准之一,愈发被名校看重,AP课程除了可以增加名校申请概率、换学分提前毕业这些快被说烂了的原因,还 ……[查看]
2023-02-09

ap心理学是什么,学心理还要学生物?
ap心理学是什么?大家小时候有瞎拆东西的经历吗? 无论是什么东西——比如遥控器、机器人、雨伞、收音机——只要到了我的手里,就一定会被拆得四分五裂,因为我很好奇这 ……[查看]
2023-02-03
最新动态













